Ответственность за отсутствие знака шипы: Обязателен или нет знак шипы в 2023 году?
Казахстанцев будут штрафовать за отсутствие знака «Шипы»
По информации Комитета административной полиции МВД РК, согласно Правилам дорожного движения РК, а именно пункту 9 раздела «Основные положения по допуску транспортных средств» ПДД РК, на автомобиле должен быть установлен знак «Шипы», если он оборудован шипованной резиной, сообщили в пресс-службе ДВД Павлодарской области.
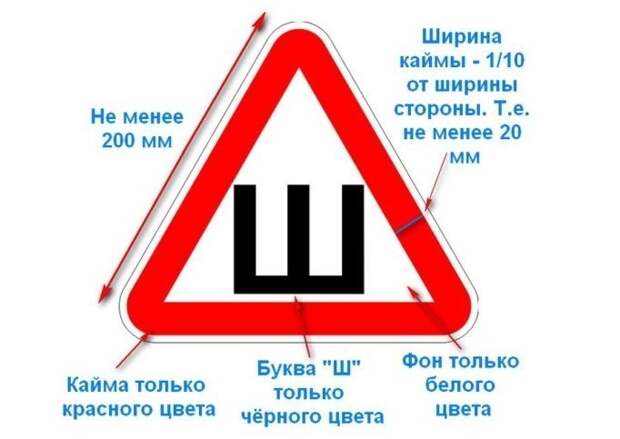
Сам знак имеет определенный стандарт. Это должен быть равносторонний треугольник белого цвета с каймой красного цвета, в который вписана буква «Ш» черного цвета. Сторона треугольника не менее 200 миллиметров, ширина каймы — 1/10 стороны. Знак клеится на заднем стекле автомобиля.
«В случае неисполнения указанных требований ПДД ответственность предусмотрена статьей 620 Кодекса РК об административных правонарушениях «Нарушение иных требований, предъявляемых к участникам дорожного движения», по которой предусмотрена ответственность — предупреждение или штраф в размере 3 МРП (6 363 тенге)», — сообщил заместитель начальника управления административной практики КАП Бауржан Нурахметов.
По его словам, если водителя останавливают в первый раз за отсутствие знака «Шипы», то ему полицейский сделает предупреждение. Если же нарушение произойдет несколько раз, то тогда последует штраф.
«Здесь полицейский будет исходит из обстоятельств дела. Если водитель предупреждался уже, то сотрудник может проверить это по базе. Предупреждение также является видом административного взыскания», — уточнил собеседник.
Техрегламент ТС «О безопасности колесных транспортных средств», вступивший в силу в 2015 году, запрещает использовать летние покрышки в зимний период и шипованные — летом, а кроме того, вводит ограничение по остаточной глубине протектора покрышек. Так, на летней резине высота протектора должна быть не менее 1,6 миллиметра, а зимней — четыре миллиметра. Колеса должны иметь маркировку знаком в виде горной вершины с тремя пиками и снежинки внутри, а также маркировки «М+S», «M & S» и «M S.
Соответственно, если на всесезонных шинах имеются эти маркировки, то зимой на них ездить можно будет. В противном случае, такая резина будет запрещена. Использовать всесезонные шины в теплое время года не запрещается. Летом запрет распространяется только на колеса с шипами.
В противном случае, такая резина будет запрещена. Использовать всесезонные шины в теплое время года не запрещается. Летом запрет распространяется только на колеса с шипами.
С 1 января 2016 года, согласно техрегламенту, начали действовать ограничения по количеству шипов на резине. «Шина должна быть приспособлена для установки шипов противоскольжения. Изготовитель должен рекомендовать шипы, предназначенные для установки на данный тип шины по длине шипа и диаметру верхнего фланcа. При этом выступ шипа за пределы протектора составляет 1,2 плюс-минус 0,3 миллиметра. По количеству шипов. Максимальное количество шипов на один погонный метр составляет 60 штук. Требования применяются к шинам, изготовленным после 1 января 2016 года», — пояснял детали техрегламента начальник отдела сопровождения проектов РГП «Казахстанский институт стандартизации и сертификации» Миргали Умаров.
Штрафовать за отсутствие знака «Шипы» будут, но не сразу / 30 ноября 2016 — новости почитать на Колёсах
Этой осенью среди автомобилистов получил популярность слух о том, что с 1 декабря 2016 года гаишники станут нещадно наказывать водителей авто с шипованными колёсами без знака «Шипы». Разбираемся, что из этого правда, а что нет.
Разбираемся, что из этого правда, а что нет.
Фото: www.nakleykiavto.ru
Штрафовать имели право и раньше
Начнём с того, что требования, обязывающие водителей устанавливать опознавательный знак «Шипы» в случае управления машиной с зимней ошипованной резиной, прописаны в ПДД давно и никаких изменений по этому поводу ни в Правила дорожного движения, ни в Административный кодекс не вносилось. Руководство управления административной практики КАП МВД РК пояснило нам, что информация, рассылаемая в Интернете, просто очередная пугалка, придуманная сетевыми троллями. Приказа отлавливать шипованные автомобили с 1 декабря не было.
Штраф заплатить придётся, но не сразу
Тем не менее за отсутствие соответствующего знака предусмотрена административная ответственность, согласно статье 620 КоАП РК, и квалифицируется, как нарушение иных требований, предъявляемых к участникам дорожного движения. За данное нарушение предусмотрен штраф в виде предупреждения в первый раз, а попавшись во второй, придётся заплатить 3 МРП, или 6 363 тенге. При этом в протоколе указывается, какая именно норма правил обеспечения безопасности дорожного движения нарушена.
При этом в протоколе указывается, какая именно норма правил обеспечения безопасности дорожного движения нарушена.
Таким образом, получив постановление о вынесении предупреждения, водитель должен как можно быстрее устранить нарушение, то есть установить опознавательный знак «Шипы». Срок устранения нарушения не установлен, однако уже на следующий день полицейские имеют право выписать денежный штраф.
Каким должен быть знак
Итак, знак «Шипы» при наличии шипованной резины обязателен, но каким он должен быть? Его можно изготовить и самостоятельно, нарисовав красками или фломастерами. Главное, чтобы были соблюдены основные требования к знаку:
— знак представляет собой равносторонний треугольник белого цвета со стороной не менее 200 мм;
— кайма должна быть красного цвета, а её ширина — 1/10 от стороны треугольника;
— сам знак не должен закрывать задний обзор и хорошо читаться с расстояния не менее 20 м.
30 ноября 2016 в 15:53 39698 просмотров Распечатать страницу
По категориям
- Архив новостей3658
- Новые автомобили783
- ДТП704
- Дороги618
- Авторынок545
- Мировой автопром503
- Штрафы269
- Полиция252
- Топливо239
- Безопасность движения221
- Криминал162
- Общественный транспорт161
- Автопром Казахстана149
- Новые технологии139
- Концепт-кары129
- Регистрация автомобилей98
- Парковки96
- Анонсы мероприятий91
- Чрезвычайные ситуации91
- Новости автоспорта85
- ПДД82
- Таможня74
- Статистика61
- Водительское удостоверение57
- Госномера54
- Налоги49
- Транспортная инфраструктура48
- Автомобили из Кыргызстана32
- Техосмотр31
- Автозапчасти27
- Мотоциклы22
- Погода21
- Доверенность16
- Производство14
- Полезная информация11
- Пешеходы9
- Автострахование6
Популярные новости
Домены и функции шиповидного белка при SARS-Cov-2 в контексте дизайна вакцины
1. Чжоу П., Ян С.-Л., Ван С.-Г., Ху Б., Чжан Л., Чжан W., Si H.-R., Zhu Y., Li B., Huang C.-L., et al. Вспышка пневмонии, связанная с новым коронавирусом вероятного происхождения от летучих мышей. Природа. 2020; 579: 270–273. doi: 10.1038/s41586-020-2012-7. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Чжоу П., Ян С.-Л., Ван С.-Г., Ху Б., Чжан Л., Чжан W., Si H.-R., Zhu Y., Li B., Huang C.-L., et al. Вспышка пневмонии, связанная с новым коронавирусом вероятного происхождения от летучих мышей. Природа. 2020; 579: 270–273. doi: 10.1038/s41586-020-2012-7. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2. Хоффманн М., Кляйне-Вебер Х., Пельманн С. Сайт многоосновного расщепления в шиповидном белке SARS-CoV-2 необходим для инфекции клеток легких человека. Мол. Клетка. 2020;78:779–784.e775. doi: 10.1016/j.molcel.2020.04.022. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
3. Хоффманн М., Кляйне-Вебер Х., Шредер С., Крюгер Н., Херрлер Т., Эриксен С., Ширгенс Т.С., Херрлер Г. ., Wu N.H., Nitsche A., et al. Проникновение в клетку SARS-CoV-2 зависит от ACE2 и TMPRSS2 и блокируется клинически проверенным ингибитором протеазы. Клетка. 2020;181:271–280.e278. [Бесплатная статья PMC] [PubMed] [Google Scholar]
4. Ou X., Liu Y., Lei X., Li P., Mi D. , Ren L., Guo L., Guo R., Chen T ., Ху Дж. и др. Характеристика спайкового гликопротеина SARS-CoV-2 при проникновении вируса и его перекрестная иммунная реактивность с SARS-CoV. Нац. коммун. 2020;11:1620. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Ren L., Guo L., Guo R., Chen T ., Ху Дж. и др. Характеристика спайкового гликопротеина SARS-CoV-2 при проникновении вируса и его перекрестная иммунная реактивность с SARS-CoV. Нац. коммун. 2020;11:1620. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Ли Ф., Ли В., Фарзан М., Харрисон С.С. Структура домена, связывающего рецептор спайка коронавируса SARS, в комплексе с рецептором. Наука. 2005; 309: 1864–1868. doi: 10.1126/science.1116480. [PubMed] [CrossRef] [Google Scholar]
6. Lu G., Wang Q., Gao G.F. От летучей мыши к человеку: признаки шипа определяют «переход хозяина» коронавирусов SARS-CoV, MERS-CoV и других. Тенденции микробиол. 2015; 23: 468–478. doi: 10.1016/j.tim.2015.06.003. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7. Халсвит Р.Дж.Г., де Хаан К.А.М., Бош Б.Дж. Коронавирусный спайковый белок и изменения тропизма. В: Ziebuhr J., редактор. Успехи в исследованиях вирусов. Том 96. Академическая пресса; Кембридж, Массачусетс, США: 2016. стр. 29–57. [Бесплатная статья PMC] [PubMed] [Google Scholar]
стр. 29–57. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Coutard B., Valle C., de Lamballerie X., Canard B., Seidah NG, Decroly E. Спайковый гликопротеин нового коронавируса 2019-nCoV содержит фуриноподобный сайт расщепления, отсутствующий в CoV той же клады. Антивир. Рез. 2020;176:104742. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Walls A.C., Tortorici M.A., Bosch B.-J., Frenz B., Rottier PJM, DiMaio F., Rey F.A., Veesler D. Криоэлектронная микроскопия структуры тримера гликопротеина шипа коронавируса. Природа. 2016; 531:114–117. doi: 10.1038/nature16988. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Предварительно слитая структура шиповидного белка человеческого коронавируса. Природа. 2016; 531:118–121. doi: 10.1038/nature17200. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
11. Уоллс А.С., Парк Ю.Дж., Торторичи М.А., Уолл А., Макгуайр А.Т., Вислер Д. Структура, функция и антигенность гликопротеина шипа SARS-CoV-2. Клетка. 2020;181:281–292.e286. doi: 10.1016/j.cell.2020.02.058. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Клетка. 2020;181:281–292.e286. doi: 10.1016/j.cell.2020.02.058. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
12. Wrapp D., Wang N., Corbett K.S., Goldsmith J.A., Hsieh C.-L., Abiona O., Graham B.S., McLellan J.S. Крио-ЭМ структура шипа 2019-nCoV в конформации префузии. Наука. 2020;367:1260. doi: 10.1126/science.abb2507. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
13. Lan J., Ge J., Yu J., Shan S., Zhou H., Fan S., Zhang Q., Shi X., Wang Q., Zhang L., et al. Структура домена, связывающего шиповидный рецептор SARS-CoV-2, связанного с рецептором ACE2. Природа. 2020; 581: 215–220. doi: 10.1038/s41586-020-2180-5. [PubMed] [CrossRef] [Google Scholar]
14. Шан Дж., Е Г., Ши К., Ван Ю., Луо С., Айхара Х., Гэн К., Ауэрбах А., Ли Ф. Structural основе распознавания рецепторов SARS-CoV-2. Природа. 2020; 581: 221–224. doi: 10.1038/s41586-020-2179-y. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Tian X., Li C., Huang A. , Xia S., Lu S., Shi Z., Lu L., Jiang S., Yang Z., Wu Y., et al. Мощное связывание шиповидного белка нового коронавируса 2019 года с человеческим моноклональным антителом, специфичным к коронавирусу SARS. Эмердж. микроб. Заразить. 2020; 9: 382–385. doi: 10.1080/22221751.2020.1729069. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Xia S., Lu S., Shi Z., Lu L., Jiang S., Yang Z., Wu Y., et al. Мощное связывание шиповидного белка нового коронавируса 2019 года с человеческим моноклональным антителом, специфичным к коронавирусу SARS. Эмердж. микроб. Заразить. 2020; 9: 382–385. doi: 10.1080/22221751.2020.1729069. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
16. Xia X. DAMBE5: комплексный программный пакет для анализа данных в области молекулярной биологии и эволюции. Мол. биол. Эвол. 2013; 30:1720–1728. дои: 10.1093/молбев/mst064. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
17. Лай М.М., Кавана Д. Молекулярная биология коронавирусов. Доп. Вирус рез. 1997; 48:1–100. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Чакраборти С., Прабакаран П., Сяо Х., Димитров Д.С. Домен, связывающий рецептор гликопротеина S коронавируса SARS: точное картирование и функциональная характеристика. Вирол. Дж. 2005; 2:73. doi: 10.1186/1743-422X-2-73. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
19. Xiao X., Feng Y., Chakraborti S., Dimitrov D.S. Олигомеризация гликопротеина S SARS-CoV: димеризация N-конца и тримеризация эктодомена. Биохим. Биофиз. Рез. коммун. 2004; 322:93–99. doi: 10.1016/j.bbrc.2004.07.084. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Xiao X., Feng Y., Chakraborti S., Dimitrov D.S. Олигомеризация гликопротеина S SARS-CoV: димеризация N-конца и тримеризация эктодомена. Биохим. Биофиз. Рез. коммун. 2004; 322:93–99. doi: 10.1016/j.bbrc.2004.07.084. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
20. Beniac D.R., deVarennes S.L., Andonov A., He R., Booth T.F. Конформационная реорганизация спайка коронавируса SARS после связывания с рецептором: последствия для слияния мембран. ПЛОС ОДИН. 2007;2:e1082. doi: 10.1371/journal.pone.0001082. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
21. Маду И.Г., Белузар С., Уиттакер Г.Р. Домен S2 шипа SARS-коронавируса, фланкированный остатками цистеина C822 и C833, важен для активации слияния мембран. Вирусология. 2009; 393: 265–271. doi: 10.1016/j.virol.2009.07.038. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
22. Мицуки Ю.Ю., Охниси К., Такаги Х., Осима М., Ямамото Т., Мизукоши Ф., Терахара К., Кобаяси К., Ямамото Н. , Ямаока С. и др. Единственная аминокислотная замена в доменах шиповидных белков S1 и S2 определяет фенотип SARS-CoV, избегающий нейтрализации. микробы заражают. 2008;10:908–915. doi: 10.1016/j.micinf.2008.05.009. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Ямаока С. и др. Единственная аминокислотная замена в доменах шиповидных белков S1 и S2 определяет фенотип SARS-CoV, избегающий нейтрализации. микробы заражают. 2008;10:908–915. doi: 10.1016/j.micinf.2008.05.009. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
23. Ng OW, Keng CT, Leung C.S., Peiris JS, Poon L.L., Tan YJ. нейтрализующее моноклональное антитело, нацеленное на домен S2. ПЛОС ОДИН. 2014;9:e102415. doi: 10.1371/journal.pone.0102415. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
24. Song H.C., Seo M.Y., Stadler K., Yoo B.J., Choo Q.L., Coates S.R., Uematsu Y., Harada T., Greer C.E., Polo Дж. М. и др. Синтез и характеристика нативной олигомерной формы рекомбинантного гликопротеина спайка коронавируса тяжелого острого респираторного синдрома. Дж. Вирол. 2004;78:10328–10335. дои: 10.1128/ОВИ.78.19.10328-10335.2004. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
25. Jin D.Y., Zheng B.J. Роль шиповидного белка в патогенезе коронавируса SARS. Гонконг Мед. Дж. 2009; 15:37–40. [PubMed] [Google Scholar]
Гонконг Мед. Дж. 2009; 15:37–40. [PubMed] [Google Scholar]
26. Xia X. Контроль трансляции HAC1 путем регуляции сплайсинга в Saccharomyces cerevisiae . Междунар. Дж. Мол. науч. 2019;20:2860. doi: 10.3390/ijms20122860. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Chow K.Y., Yeung Y.S., Hon C.C., Zeng F., Law K.M., Leung F.C. Опосредованной аденовирусом экспрессии С-концевого домена шиповидного белка SARS-CoV достаточно, чтобы вызвать апоптоз в клетках Vero E6. ФЭБС лат. 2005;579: 6699–6704. doi: 10.1016/j.febslet.2005.10.065. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
28. Шаджахан А., Супекар Н.Т., Глейнич А.С., Азади П. Вывод профиля N- и О-гликозилирования шиповидного белка нового коронавируса SARS- КоВ-2. Гликобиология. 2020; 30: 981–988. doi: 10.1093/гликоб/cwaa042. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. Андерсен К.Г., Рамбо А., Липкин В.И., Холмс Э.К., Гарри Р.Ф. Проксимальное происхождение SARS-CoV-2. Нац. Мед. 2020; 26: 450–452. дои: 10.1038/s41591-020-0820-9. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Нац. Мед. 2020; 26: 450–452. дои: 10.1038/s41591-020-0820-9. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
30. Fagerberg L., Hallström B.M., Oksvold P., Kampf C., Djureinovic D., Odeberg J., Habuka M., Tahmasebpoor S., Даниэльссон А., Эдлунд К. и др. Анализ тканеспецифичной экспрессии человека путем полногеномной интеграции транскриптомики и протеомики на основе антител. Мол. Клетка. протеом. 2014;13:397–406. doi: 10.1074/mcp.M113.035600. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
31. Sun X., Tse L.V., Ferguson A.D., Whittaker G.R. Модификации сайта расщепления гемагглютинина контролируют вирулентность нейротропного вируса гриппа h2N1. Дж. Вирол. 2010;84:8683. дои: 10.1128/ОВИ.00797-10. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
32. Кидо Х., Окумура Ю., Такахаши Э., Пан Х.-Ю., Ван С., Яо Д., Яо М., Чида Дж., Яно М. Роль клеточных протеаз хозяина в патогенезе гриппа и полиорганной недостаточности, вызванной гриппом. Биохим. Биофиз. Acta Proteins Proteom. 2012; 1824: 186–194. doi: 10.1016/j.bbapap.2011.07.001. [PubMed] [CrossRef] [Google Scholar]
Биохим. Биофиз. Acta Proteins Proteom. 2012; 1824: 186–194. doi: 10.1016/j.bbapap.2011.07.001. [PubMed] [CrossRef] [Google Scholar]
33. Wei Y., Silke J.R., Aris P., Xia X. Геномы коронавирусов несут в себе признаки среды их обитания. ПЛОС ОДИН. 2020;15:e0244025. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Белузар С., Чу В.К., Уиттакер Г.Р. Активация спайкового белка коронавируса SARS посредством последовательного протеолитического расщепления в двух разных местах. проц. Натл. акад. науч. США. 2009; 106: 5871–5876. doi: 10.1073/pnas.0809524106. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
35. Hsieh C.-L., Goldsmith J.A., Schaub J.M., DiVenere A.M., Kuo H.-C., Javanmardi K., Le K.C., Wrapp Д., Ли А.Г., Лю Ю. и др. Основанный на структуре дизайн шипов SARS-CoV-2, стабилизированных до слияния. Наука. 2020;369:1501. doi: 10.1126/science.abd0826. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
36. Симмонс Г., Госалия Д.Н., Реннекамп А. Дж., Ривз Дж.Д., Даймонд С.Л., Бейтс П. Ингибиторы катепсина L предотвращают проникновение коронавируса тяжелого острого респираторного синдрома. проц. Натл. акад. науч. США. 2005; 102:11876. doi: 10.1073/pnas.0505577102. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Дж., Ривз Дж.Д., Даймонд С.Л., Бейтс П. Ингибиторы катепсина L предотвращают проникновение коронавируса тяжелого острого респираторного синдрома. проц. Натл. акад. науч. США. 2005; 102:11876. doi: 10.1073/pnas.0505577102. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
37. Bosch B.J., Bartelink W., Rottier P.J.M. Катепсин L функционально расщепляет гибридный белок коронавируса класса I тяжелого острого респираторного синдрома выше, а не рядом с гибридным пептидом. Дж. Вирол. 2008;82:8887. doi: 10.1128/ОВИ.00415-08. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
38. Burkard C., Verheije M.H., Wicht O., van Kasteren S.I., van Kuppeveld F.J., Haagmans B.L., Pelkmans L., Rottier P.J., Bosch B.J., de Haan C.A. Проникновение клеток коронавируса происходит через эндо-/лизосомальный путь зависимым от протеолиза образом. PLoS Патог. 2014;10:e1004502. doi: 10.1371/journal.ppat.1004502. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
39. Kirschke H. Chapter 410—Cathepsin L. In: Rawlings ND, Salvesen G., editors. Справочник по протеолитическим ферментам. 3-е изд. Академическая пресса; Кембридж, Массачусетс, США: 2013. стр. 1808–1817. [Академия Google]
Kirschke H. Chapter 410—Cathepsin L. In: Rawlings ND, Salvesen G., editors. Справочник по протеолитическим ферментам. 3-е изд. Академическая пресса; Кембридж, Массачусетс, США: 2013. стр. 1808–1817. [Академия Google]
40. Джеймс Дж.А., Андре Н.М., Чаппи Дж.С., Милле Дж.К., Уиттакер Г.Р. Филогенетический анализ и структурное моделирование шиповидного белка SARS-CoV-2 выявили особую эволюционную и протеолитически чувствительную петлю активации. Дж. Мол. биол. 2020; 432:3309–3325. doi: 10.1016/j.jmb.2020.04.009. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
41. Мацуяма С., Нагата Н., Ширато К., Кавасэ М., Такеда М., Тагучи Ф. Эффективная активация тяжелого острого респираторного синдрома Спайковый белок коронавируса с помощью трансмембранной протеазы TMPRSS2. Дж. Вирол. 2010;84:12658. doi: 10.1128/ОВИ.01542-10. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
42. Хоффманн М., Хофманн-Винклер Х., Пёльманн С. Время прайминга: как клеточные протеазы усиливают шиповидные белки коронавируса. В: Бёттхер-Фрибертсхойзер Э., Гартен В., Кленк Х.Д., редакторы. Активация вирусов протеазами-хозяевами. Международное издательство Спрингер; Чам, Швейцария: 2018. стр. 71–98. [Google Scholar]
В: Бёттхер-Фрибертсхойзер Э., Гартен В., Кленк Х.Д., редакторы. Активация вирусов протеазами-хозяевами. Международное издательство Спрингер; Чам, Швейцария: 2018. стр. 71–98. [Google Scholar]
43. Glowacka I., Bertram S., Müller M.A., Allen P., Soilleux E., Pfefferle S., Steffen I., Tsegaye T.S., He Y., Gnirss K., et al. Доказательства того, что TMPRSS2 активирует шиповидный белок коронавируса тяжелого острого респираторного синдрома для слияния мембран и снижает вирусный контроль за счет гуморального иммунного ответа. Дж. Вирол. 2011;85:4122–4134. doi: 10.1128/ОВИ.02232-10. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
44. Kleine-Weber H., Elzayat M.T., Hoffmann M., Pöhlmann S. Функциональный анализ потенциальных сайтов расщепления шиповидного белка MERS-коронавируса. науч. 2018; 8:16597. doi: 10.1038/s41598-018-34859-w. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
45. Симмонс Г., Ривз Дж.Д., Реннекамп А.Дж., Амберг С.М., Пифер А. Дж., Бейтс П. CoV) опосредованное гликопротеином проникновение вируса. проц. Натл. акад. науч. США. 2004; 101:4240–4245. doi: 10.1073/pnas.0306446101. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Дж., Бейтс П. CoV) опосредованное гликопротеином проникновение вируса. проц. Натл. акад. науч. США. 2004; 101:4240–4245. doi: 10.1073/pnas.0306446101. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
46. Мацуяма С., Удзике М., Морикава С., Таширо М., Тагучи Ф. Опосредованное протеазами усиление тяжелого острого респираторного синдрома при коронавирусной инфекции. проц. Натл. акад. науч. США. 2005;102:12543. doi: 10.1073/pnas.0503203102. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
47. Peng G., Sun D., Rajashankar K.R., Qian Z., Holmes K.V., Li F. Кристаллическая структура комплексного домена, связывающего рецептор мышиного коронавируса со своим мышиным рецептором. проц. Натл. акад. науч. США. 2011;108:10696. doi: 10.1073/pnas.1104306108. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
48. Уильямс Р.К., Цзян Г.С., Холмс К.В. Рецептор вируса гепатита мыши является членом семейства гликопротеинов карциноэмбрионального антигена. проц. Натл. акад. науч. США. 1991;88:5533. doi: 10.1073/pnas.88.13.5533. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
проц. Натл. акад. науч. США. 1991;88:5533. doi: 10.1073/pnas.88.13.5533. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
49. Xia X. DAMBE7: Новые и улучшенные инструменты для анализа данных в молекулярной биологии и эволюции. Мол. биол. Эвол. 2018;35:1550–1552. дои: 10.1093/молбев/msy073. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
50. Gui M., Song W., Zhou H., Xu J., Chen S., Xiang Y., Wang X. Криоэлектронная микроскопия структуры шиповидного гликопротеина SARS-CoV обнаруживают необходимое конформационное состояние для связывания с рецептором. Сотовый рез. 2017;27:119–129. doi: 10.1038/cr.2016.152. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
51. Захарчук А.Н., Шарон С., Саткунараджа М., Ауперин Т., Вишванатан С., Мутвири Г., Петрик М., See R.H., Brunham R.C., Finlay B.B. и соавт. Иммуногенность рецептор-связывающего домена шиповидного белка коронавируса SARS у мышей: последствия для субъединичной вакцины. вакцина. 2007; 25: 136–143. doi: 10.1016/j.vaccine.2006.06.084. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2007; 25: 136–143. doi: 10.1016/j.vaccine.2006.06.084. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
52. He Y., Zhou Y., Liu S., Kou Z., Li W., Farzan M., Jiang S. Рецептор-связывающий домен спайкового белка SARS-CoV индуцирует сильнодействующие нейтрализующие антитела: значение для развития субъединичная вакцина. Биохим. Биофиз. Рез. коммун. 2004; 324: 773–781. doi: 10.1016/j.bbrc.2004.09.106. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
53. He Y., Zhou Y., Siddiqui P., Jiang S. Инактивированная вакцина против SARS-CoV вызывает высокие титры специфичных к шиповидному белку антител, которые блокируют связывание с рецептором и проникновение вируса. Биохим. Биофиз. Рез. коммун. 2004; 325:445–452. doi: 10.1016/j.bbrc.2004.10.052. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
54. Du L., Zhao G., Chan C.C., Sun S., Chen M., Liu Z., Guo H., He Y., Zhou Y., Zheng B.J., et al. Рекомбинантный рецептор-связывающий домен шиповидного белка SARS-CoV, экспрессируемый в клетках млекопитающих, насекомых и кишечной палочки, вызывает сильнодействующие нейтрализующие антитела и защитный иммунитет. Вирусология. 2009; 393: 144–150. doi: 10.1016/j.virol.2009.07.018. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Вирусология. 2009; 393: 144–150. doi: 10.1016/j.virol.2009.07.018. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
55. Du L., Zhao G., He Y., Guo Y., Zheng B.J., Jiang S., Zhou Y. Рецепторно-связывающий домен Спайковый белок SARS-CoV индуцирует долгосрочный защитный иммунитет у животных моделей. вакцина. 2007; 25: 2832–2838. doi: 10.1016/j.vaccine.2006.10.031. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
56. Du L., Zhao G., Lin Y., Sui H., Chan C., Ma S., He Y., Jiang S., Wu C., Yuen K.Y., et al. Интраназальная вакцинация рекомбинантным аденоассоциированным вирусом, кодирующим шиповидный белок рецептор-связывающего домена коронавируса тяжелого острого респираторного синдрома (SARS-CoV), вызывает сильные иммунные реакции слизистых оболочек и обеспечивает долгосрочную защиту от инфекции SARS-CoV. Дж. Иммунол. 2008; 180:948–956. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Zhang X., Wang J., Wen K., Mou Z., Zou L., Che X., Ni B. , Wu Y. Сайт связывания антител картирование домена, связывающего рецептор спайкового белка SARS-CoV, с помощью комбинации поверхностного дисплея дрожжей и скрининга библиотеки фаговых пептидов. Вирус Иммунол. 2009 г.;22:407–415. [PubMed] [Google Scholar]
, Wu Y. Сайт связывания антител картирование домена, связывающего рецептор спайкового белка SARS-CoV, с помощью комбинации поверхностного дисплея дрожжей и скрининга библиотеки фаговых пептидов. Вирус Иммунол. 2009 г.;22:407–415. [PubMed] [Google Scholar]
58. Cao Z., Liu L., Du L., Zhang C., Jiang S., Li T., He Y. Мощный и стойкий ответ антител против рецептор-связывающего домена Спайковый белок SARS-CoV у выздоровевших пациентов. Вирол. Дж. 2010; 7:299. [PMC free article] [PubMed] [Google Scholar]
59. Prabakaran P., Gan J., Feng Y., Zhu Z., Choudhry V., Xiao X., Ji X., Dimitrov D.S. Структура тяжелого острого Домен связывания рецептора коронавируса респираторного синдрома в комплексе с нейтрализующим антителом. Дж. Биол. хим. 2006;281:15829–15836. doi: 10.1074/jbc.M600697200. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
60. Chen WH, Du L., Chag S.M., Ma C., Tricoche N., Tao X., Seid C.A., Hudspeth EM, Lustigman S. , Tseng C.T., et al. Экспрессируемый дрожжами рекомбинантный белок рецептор-связывающего домена шиповидного белка SARS-CoV с дегликозилированными формами в качестве кандидата на вакцину против SARS. Гум. Вакцины Иммунотер. 2014; 10: 648–658. [Статья бесплатно PMC] [PubMed] [Google Scholar]
Гум. Вакцины Иммунотер. 2014; 10: 648–658. [Статья бесплатно PMC] [PubMed] [Google Scholar]
61. Du L., Ma C., Jiang S. Антитела, индуцированные рецептор-связывающим доменом в спайковом белке SARS-CoV, не перекрестно нейтрализуют новый коронавирус человека. ВГС-ЭМС. Дж. Заразить. 2013;67:348–350. [Бесплатная статья PMC] [PubMed] [Google Scholar]
62. Zhu Z., Chakraborti S., He Y., Roberts A., Sheahan T., Xiao X., Hensley L.E., Prabakaran P., Rockx B., Sidorov I.A., et al. Мощная перекрестно-реактивная нейтрализация изолятов коронавируса SARS человеческими моноклональными антителами. проц. Натл. акад. науч. США. 2007;104:12123–12128. [Бесплатная статья PMC] [PubMed] [Google Scholar]
63. Elshabrawy H.A., Coughlin M.M., Baker S.C., Prabhakar B.S. Моноклональные антитела человека против высококонсервативных доменов HR1 и HR2 шиповидного белка SARS-CoV нейтрализуют в более широком смысле. ПЛОС ОДИН. 2012;7:e50366. [Бесплатная статья PMC] [PubMed] [Google Scholar]
64. He Y., Li J., Jiang S. Замена одной аминокислоты (R441A) в рецептор-связывающем домене шиповидного белка коронавируса SARS нарушает антигенную структуру и связывающую активность. Биохим. Биофиз. Рез. коммун. 2006; 344:106–113. doi: 10.1016/j.bbrc.2006.03.139. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
He Y., Li J., Jiang S. Замена одной аминокислоты (R441A) в рецептор-связывающем домене шиповидного белка коронавируса SARS нарушает антигенную структуру и связывающую активность. Биохим. Биофиз. Рез. коммун. 2006; 344:106–113. doi: 10.1016/j.bbrc.2006.03.139. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
65. Poh W.P., Narasaraju T., Pereira N.A., Zhong F., Phoon M.C., Macary P.A., Wong S.H., Lu J., Koh D.R., Chow В.Т. Характеристика эпитопов цитотоксических Т-лимфоцитов и иммунных ответов на ДНК-вакцину с шипами коронавируса SARS, экспрессирующую RGD-интегрин-связывающий мотив. Дж. Мед. Вирол. 2009 г.;81:1131–1139. doi: 10.1002/jmv.21571. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
66. Lin Y.S., Lin C.F., Fang Y.T., Kuo Y.M., Liao PC, Yeh TM, Hwa K.Y., Shieh C.C., Yen J.H., Wang H.J., et др. Антитело к домену 2 шиповидного белка коронавируса, связанного с тяжелым острым респираторным синдромом (SARS), перекрестно реагирует с эпителиальными клетками легких и вызывает цитотоксичность. клин. Эксп. Иммунол. 2005; 141: 500–508. doi: 10.1111/j.1365-2249.2005.02864.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
клин. Эксп. Иммунол. 2005; 141: 500–508. doi: 10.1111/j.1365-2249.2005.02864.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
67. Уайт Дж.М., Делос С.Е., Брехер М., Шорнберг К. Структуры и механизмы белков слияния вирусных мембран: многочисленные вариации на общую тему. крит. Преподобный Биохим. Мол. биол. 2008;43:189–219. doi: 10.1080/10409230802058320. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
68. Bosch B.J., Martina B.E., Van Der Zee R., Lepault J., Haijema B.J., Versluis C., Heck A.J., De Groot R., Остерхаус А. Д., Ротье П. Дж. Ингибирование инфекции коронавируса тяжелого острого респираторного синдрома (SARS-CoV) с использованием пептидов, полученных из гептадных повторов шиповидного белка. проц. Натл. акад. науч. США. 2004; 101:8455–8460. doi: 10.1073/pnas.0400576101. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
69. Броер Р., Босон Б., Спаан В., Коссет Ф.Л., Корвер Дж. Важная роль трансмембранного домена шиповидного белка коронавируса тяжелого острого респираторного синдрома во время проникновения. Дж. Вирол. 2006; 80: 1302–1310. doi: 10.1128/ОВИ.80.3.1302-1310.2006. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Дж. Вирол. 2006; 80: 1302–1310. doi: 10.1128/ОВИ.80.3.1302-1310.2006. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
70. Modis Y. Слитые белки класса II. Доп. Эксп. Мед. биол. 2013; 790:150–166. [Бесплатная статья PMC] [PubMed] [Google Scholar]
71. Zeng X., Herndon A.M., Hu JC. Скрытые аспарагины определяют специфичность димеризации мутантов лейциновой молнии. проц. Натл. акад. науч. США. 1997;94:3673. doi: 10.1073/pnas.94.8.3673. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
72. Yoshida H., Oku M., Suzuki M., Mori K. pXBP1(U), закодированная в пре-мРНК XBP1, негативно регулирует развернутый активатор ответа белка pXBP1(S) в стрессовой реакции ER млекопитающих. Дж. Селл. биол. 2006; 172: 565–575. doi: 10.1083/jcb.200508145. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
73. Ся X. За пределами деревьев: регулоны и характеристика регуляторных мотивов. Гены. 2020;11:995. doi: 10.3390/genes11090995. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
74. Chambers P., Pringle C.R., Easton A.J. Последовательности гептадных повторов расположены рядом с гидрофобными областями в нескольких типах гликопротеинов слияния вирусов. Дж. Генерал Вирол. 1990;71:3075–3080. doi: 10.1099/0022-1317-71-12-3075. [PubMed] [CrossRef] [Google Scholar]
Chambers P., Pringle C.R., Easton A.J. Последовательности гептадных повторов расположены рядом с гидрофобными областями в нескольких типах гликопротеинов слияния вирусов. Дж. Генерал Вирол. 1990;71:3075–3080. doi: 10.1099/0022-1317-71-12-3075. [PubMed] [CrossRef] [Google Scholar]
75. Basak S., Hao X., Chen A., Chrétien M., Basak A. Структурное и биохимическое исследование пептидов, полученных из гептадных повторов, вируса короны SARS человека (hSARS- CoV) шиповидный белок. Белковый пепт. лат. 2008; 15: 874–886. дои: 10.2174/092986608785849173. [PubMed] [CrossRef] [Google Scholar]
76. Xia S., Liu M., Wang C., Xu W., Lan Q., Feng S., Qi F., Bao L., Du L. ., Лю С. и др. Ингибирование инфекции SARS-CoV-2 (ранее 2019-nCoV) с помощью сильнодействующего ингибитора слияния панкоронавирусов, нацеленного на его шиповидный белок, который обладает высокой способностью опосредовать слияние мембран. Сотовый рез. 2020; 30: 343–355. doi: 10.1038/s41422-020-0305-x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
77. Юань Ю., Цао Д., Чжан Ю., Ма Дж., Ци Дж., Ван Ц., Лу Г., Ву Ю. , Ян Дж., Ши Ю. и др. Крио-ЭМ-структуры шиповидных гликопротеинов MERS-CoV и SARS-CoV выявляют динамические домены связывания рецепторов. Нац. коммун. 2017;8:15092. doi: 10.1038/ncomms15092. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Юань Ю., Цао Д., Чжан Ю., Ма Дж., Ци Дж., Ван Ц., Лу Г., Ву Ю. , Ян Дж., Ши Ю. и др. Крио-ЭМ-структуры шиповидных гликопротеинов MERS-CoV и SARS-CoV выявляют динамические домены связывания рецепторов. Нац. коммун. 2017;8:15092. doi: 10.1038/ncomms15092. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
78. Ni L., Zhu J., Zhang J., Yan M., Gao G.F., Tien P. Дизайн SARS-CoV на основе рекомбинантного белка ингибиторы проникновения, нацеленные на области гептадных повторов S2-домена шиповидного белка. Биохим. Биофиз. Рез. коммун. 2005; 330:39–45. doi: 10.1016/j.bbrc.2005.02.117. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
79. Pallesen J., Wang N., Corbett K.S., Wrapp D., Kirchdoerfer R.N., Turner H.L., Cottrell C.A., Becker M.M., Wang L., Ши В. и др. Иммуногенность и структуры рационально сконструированного префузии спайкового антигена БВРС-КоВ. проц. Натл. акад. науч. США. 2017;114:E7348. doi: 10.1073/pnas.1707304114. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
80. Корвер Дж., Броер Р., ван Кастерен П., Спаан В. Мутагенез трансмембранного домена гликопротеина спайка коронавируса SARS: уточнение требований для проникновения в клетку коронавируса SARS. Вирол. Дж. 2009; 6:230. doi: 10.1186/1743-422X-6-230. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
Корвер Дж., Броер Р., ван Кастерен П., Спаан В. Мутагенез трансмембранного домена гликопротеина спайка коронавируса SARS: уточнение требований для проникновения в клетку коронавируса SARS. Вирол. Дж. 2009; 6:230. doi: 10.1186/1743-422X-6-230. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
81. Ляо Ю., Чжан С.М., Нео Т.Л., Там Дж.П. Триптофан-зависимое мембранное взаимодействие и гетеромеризация с внутренним слитым пептидом проксимальной внешней областью мембраны Спайковый белок SARS-CoV. Биохимия. 2015;54:1819–1830. дои: 10.1021/bi501352u. [PubMed] [CrossRef] [Google Scholar]
82. Пети С.М., Чульенко В.Н., Айер А., Колгроув Р., Фарзан М., Книпе Д.М., Кусулас К.Г. Пальмитоилирование богатого цистеином эндодомена гликопротеина шипа SARS-коронавируса важно для спайко-опосредованного слияния клеток. Вирусология. 2007; 360: 264–274. doi: 10.1016/j.virol.2006.10.034. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
83. Petit C.M., Melancon J.M., Chouljenko V. N., Colgrove R., Farzan M., Knipe D.M., Kousoulas K.G. Генетический анализ функциональных доменов гликопротеиновых шипов SARS-коронавируса, участвующих в экспрессии на клеточной поверхности и слиянии клеток с клетками. Вирусология. 2005; 341: 215–230. doi: 10.1016/j.virol.2005.06.046. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
N., Colgrove R., Farzan M., Knipe D.M., Kousoulas K.G. Генетический анализ функциональных доменов гликопротеиновых шипов SARS-коронавируса, участвующих в экспрессии на клеточной поверхности и слиянии клеток с клетками. Вирусология. 2005; 341: 215–230. doi: 10.1016/j.virol.2005.06.046. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
84. Милле Дж.К., Киен Ф., Чунг С.Ю., Сиу Ю.Л., Чан В.Л., Ли Х., Леунг Х.Л., Жауме М., Бруццоне Р., Пейрис Дж.С. и др. Эзрин взаимодействует с шиповидным белком коронавируса SARS и сдерживает инфекцию на начальной стадии. ПЛОС ОДИН. 2012;7:e49566. [Бесплатная статья PMC] [PubMed] [Google Scholar]
85. Anderson E.J., Rouphael N.G., Widge AT, Jackson L.A., Roberts PC, Makhene M., Chappell J.D., Denison M.R., Stevens L.J., Pruijssers A.J., et al. Безопасность и иммуногенность мРНК-вакцины SARS-CoV-2-1273 у пожилых людей. Н. англ. Дж. Мед. 2020; 383: 2427–2438. doi: 10.1056/NEJMoa2028436. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
86. Джексон Л.А., Андерсон Э.Дж., Руфаэль Н.Г., Робертс П.С., Махен М., Колер Р.Н., Маккалоу М.П., Чаппелл Дж.Д., Денисон М.Р., Стивенс Л.Дж. и др. мРНК-вакцина против SARS-CoV-2 — предварительный отчет. Н. англ. Дж. Мед. 2020; 383:1920–1931. doi: 10.1056/NEJMoa2022483. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Джексон Л.А., Андерсон Э.Дж., Руфаэль Н.Г., Робертс П.С., Махен М., Колер Р.Н., Маккалоу М.П., Чаппелл Дж.Д., Денисон М.Р., Стивенс Л.Дж. и др. мРНК-вакцина против SARS-CoV-2 — предварительный отчет. Н. англ. Дж. Мед. 2020; 383:1920–1931. doi: 10.1056/NEJMoa2022483. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
87. Denison M.R., Graham R.L., Donaldson E.F., Eckerle L.D., Baric R.S. Коронавирусы: машина для считывания РНК регулирует точность репликации и разнообразие. РНК биол. 2011; 8: 270–279.. doi: 10.4161/rna.8.2.15013. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
88. Ferron F., Subissi L., Silveira De Morais A.T., Le N.T.T., Sevajol M., Gluais L., Decroly E., Vonrhein C. , Bricogne G., Canard B., et al. Структурно-молекулярные основы коррекции несоответствия и удаления рибавирина из РНК коронавируса. проц. Натл. акад. науч. США. 2018;115:E162–E171. doi: 10.1073/pnas.1718806115. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
89. Робсон Ф., Хан К.С., Ле Т.К., Пэрис К., Демирбаг С., Барфусс П., Рокки П., Нг В.-Л. . Вычитка РНК коронавируса: молекулярная основа и терапевтическое нацеливание. Мол. Клетка. 2020;79: 710–727. doi: 10.1016/j.molcel.2020.07.027. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Робсон Ф., Хан К.С., Ле Т.К., Пэрис К., Демирбаг С., Барфусс П., Рокки П., Нг В.-Л. . Вычитка РНК коронавируса: молекулярная основа и терапевтическое нацеливание. Мол. Клетка. 2020;79: 710–727. doi: 10.1016/j.molcel.2020.07.027. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
90. Корбер Б., Фишер В.М., Гнанакаран С., Юн Х., Тайлер Дж., Абфальтерер В., Хенгартнер Н., Гиорги Э.Э., Бхаттачарья Т., Фоли Б. и др. Отслеживание изменений в пике SARS-CoV-2: доказательства того, что D614G повышает инфекционность вируса COVID-19. Клетка. 2020;182:812–827.e819. doi: 10.1016/j.cell.2020.06.043. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
91. Юрковецкий Л., Ван С., Паскаль К.Е., Томкинс-Тинч С., Ньялиле Т.П., Ван Ю., Баум А., Диль В.Е., Дофин А., Карбон К. и др. Структурно-функциональный анализ варианта спайкового белка D614G SARS-CoV-2. Клетка. 2020;183:739–751.e738. doi: 10.1016/j.cell.2020.09.032. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
92. Zhou H., Chen X., Hu T., Li J., Song H., Liu Y., Wang P., Liu D. , Yang J., Holmes E.C., et al. Новый коронавирус летучих мышей, тесно связанный с SARS-CoV-2, содержит естественные вставки в сайте расщепления S1/S2 шиповидного белка. Курс. биол. 2020;30:2196–2203.e3. doi: 10.1016/j.cub.2020.05.023. [Статья PMC бесплатно] [PubMed] [CrossRef] [Google Scholar]
Zhou H., Chen X., Hu T., Li J., Song H., Liu Y., Wang P., Liu D. , Yang J., Holmes E.C., et al. Новый коронавирус летучих мышей, тесно связанный с SARS-CoV-2, содержит естественные вставки в сайте расщепления S1/S2 шиповидного белка. Курс. биол. 2020;30:2196–2203.e3. doi: 10.1016/j.cub.2020.05.023. [Статья PMC бесплатно] [PubMed] [CrossRef] [Google Scholar]
93. Рейнке Л.М., Шпигель М., Плегге Т., Хартлейб А., Нельмайер И., Гиерер С., Хоффманн М., Хофманн-Винклер Х. ., Winkler M., Pöhlmann S. Различные остатки в шиповидном белке SARS-CoV определяют расщепление и активацию протеазой клетки-хозяина TMPRSS2. ПЛОС ОДИН. 2017;12:e0179177. [Бесплатная статья PMC] [PubMed] [Google Scholar]
94. Yao Y.X., Ren J., Heinen P., Zambon M., Jones I.M. Расщепление и сывороточная реактивность шиповидного белка тяжелого острого респираторного синдрома при коронавирусе. Дж. Заразить. Дис. 2004; 190:91–98. дои: 10.1086/421280. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
95. Xia X. Экстремальный дефицит геномного CpG при SARS-CoV-2 и уклонение от противовирусной защиты хозяина. Мол. биол. Эвол. 2020; 37: 2699–2705. doi: 10.1093/molbev/msaa094. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Xia X. Экстремальный дефицит геномного CpG при SARS-CoV-2 и уклонение от противовирусной защиты хозяина. Мол. биол. Эвол. 2020; 37: 2699–2705. doi: 10.1093/molbev/msaa094. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
96. Таката М.А., Гонсалвеш-Карнейро Д., Занг Т.М., Солл С.Дж., Йорк А., Бланко-Мело Д., Бениас П.Д. Подавление динуклеотидов CG позволяет противовирусной защите воздействовать на чужеродную РНК. Природа. 2017; 550:124–127. doi: 10.1038/nature24039. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
97. Лобри Дж. Р. Происхождение репликации Mycoplasma genitalium . Наука. 1996; 272: 745–746. doi: 10.1126/science.272.5262.745. [PubMed] [CrossRef] [Академия Google]
98. Kleine-Weber H., Pöhlmann S., Hoffmann M. Спайковые белки новых изолятов MERS-коронавируса от североафриканских и западноафриканских одногорбых верблюдов опосредуют надежное проникновение вируса в клетки-мишени человека. Вирусология. 2019; 535: 261–265. doi: 10.1016/j.virol.2019.07.016. [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
doi: 10.1016/j.virol.2019.07.016. [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Исследователи NEIDL обнаружили новое слабое место SARS-CoV-2, которое может вдохновить на разработку улучшенных вакцин | The Brink
Nature публикует исследование COVID под руководством BU, которое попало в заголовки международных газет; Ученые считают, что вирусный белок под названием NSP6, а не просто шип, делает Омикрон менее опасным, чем предыдущие варианты
Ученые в первую очередь изучили шиповидный белок Omicron (показан здесь), чтобы понять, почему вариант SARS-CoV-2 относительно слабее исходного вируса. Теперь группа международных исследователей под руководством BU обнаружила, что мутации в другом белке, называемом NSP6, могут быть важным фактором. По дизайну Cells/iStock
COVID-19
Nature публикует исследование COVID под руководством BU, которое попало в заголовки международных газет; Ученые считают, что вирусный белок под названием NSP6, а не просто шип, делает Омикрон менее опасным, чем предыдущие варианты 11 января 2023 г.
Твиттер Фейсбук
После трех лет инфекций, самоизоляции и вакцинации мы многое знаем о SARS-CoV-2, вирусе, вызывающем COVID-19, но мы не знаем всего. Мол, почему одни варианты слабее других? Почему вариант Омикрон быстро распространяется, но делает людей менее больными? Подвергают ли нас новые мутации вируса новому риску или приближают нас к окончанию пандемии? Ожидают ли разработки более эффективные вакцины?
Новое исследование международной группы исследователей под руководством Бостонского университета может дать некоторые ответы. В статье, опубликованной в Интернете в журнале Nature , они определяют мутации, которые помогают Omicron уклоняться от предшествующего иммунитета, и показывают, что ранее неизвестный вирусный белок, известный как NSP6, может быть важным фактором более низкого болезнетворного потенциала варианта или его патогенности. . Проект, содержащий некоторые из первых результатов статьи, ранее попал в заголовки международных газет в октябре, когда серия ложных сообщений сенсационно неверно истолковала его выводы.
«Это важная часть работы, показывающая, что шиповидный белок имеет лишь минимальный вклад в более низкую патогенность Омикрона, и что существенную роль играют мутации в другом белке, NSP6», — говорит Саид, ассистент Медицинской школы Чобанана и Аведисяна. профессор биохимии. «Это дает нам захватывающую новую концепцию для будущих вакцин и терапевтических средств — если мы знаем, как ослабить вирус, мы сможем лучше бороться с ним».
Статья, которая также будет напечатана, была написана в соавторстве исследователями из Университета штата Нью-Йорк и Кливлендской клиники, Флоридского научно-исследовательского и инновационного центра, Университета Лойолы, Бригамской женской больницы (BWH), Гарвардской медицинской школы (HMS), Университета Висконсин-Мэдисон, и Фридрих-Александр-Университет Эрланген-Нюрнберг и Йоханнес Гутенберг-Университет Майнц, оба в Германии. Один из соавторов, Джонатан Ли, адъюнкт-профессор медицины BWH и HMS, говорит, что, хотя многие исследования были сосредоточены на шиповидном белке SARS-CoV-2, мало что известно об остальной части его генома.
Один из соавторов, Джонатан Ли, адъюнкт-профессор медицины BWH и HMS, говорит, что, хотя многие исследования были сосредоточены на шиповидном белке SARS-CoV-2, мало что известно об остальной части его генома.
«Части вирусного генома без шипов изучены недостаточно. Подобные исследования помогают нам понять, какие части вирусного генома влияют на патогенез, чего мы до сих пор не знаем», — говорит Ли, отмечая, что, например, непонятно, почему подвариант Omicron BA.5 легко превзошел BA. .4 версия — несмотря на то, что эти два варианта имеют одинаковые последовательности спайков. «Доктор. Исследование Саида показывает нам относительное влияние различных сегментов гена SARS-CoV-2 на тяжесть заболевания. Этот тип исследований может не только предсказать, какие варианты могут привести к новым волнам инфекции, но и определить цели для новых терапевтических средств против COVID-19.».
Слабые стороны Омикрона
Лаборатория Саида занимается изучением SARS-CoV-2 с начала вспышки, изучая первый штамм коронавируса, который был извлечен у пациента в Соединенных Штатах, известный как вашингтонский или изолят дикого типа. Когда в конце 2021 года на сцену вышел вариант Омикрон, вскоре стало ясно, что он распространяется быстрее, чем предыдущие варианты. Однако Омикрон также был слабее или аттенюированнее — менее смертоносен. Саид хотел знать почему.
Когда в конце 2021 года на сцену вышел вариант Омикрон, вскоре стало ясно, что он распространяется быстрее, чем предыдущие варианты. Однако Омикрон также был слабее или аттенюированнее — менее смертоносен. Саид хотел знать почему.
«Это вызвало относительно менее тяжелое заболевание», — говорит Саид. «Что такого особенного в Омикроне, что он вызывает более легкое заболевание? Так начался этот проект — мы хотели исследовать этот вопрос».
В защищенной лаборатории Национальной лаборатории новых инфекционных заболеваний (NEIDL) Университета штата Нью-Йорк исследователи начали с изучения шиповидного белка вируса, молекулы, которая помогает SARS-CoV-2 проникнуть в клетку и начать ее заражение. — выбрали большинство вакцин. Одной из причин такого внимания к шипу является то, что ученые определили, что он является основным отличием Омикрона от исходного вируса: большинство мутаций сконцентрировано в этом одном белке.
«Первый эксперимент, который мы провели, заключался в том, чтобы взять шип Омикрона и поместить его в вирус дикого типа», — говорит Саид, исследователь в NEIDL.
В некотором смысле, добавляет он, природа указывала путь вперед.
«Омикрон вызывает относительно легкое заболевание — природа уже говорит нам, как ослабить вирус, как вирус может ослабнуть», — говорит Саид. Ослабление вирусов уже давно используется учеными для борьбы со смертельными заболеваниями, от полиомиелита до желтой лихорадки — Луи Пастер экспериментировал с живыми аттенуированными вакцинами, используя более слабые версии вирусов еще в 1800-х годах. «Мы можем учиться у природы. Если мы сможем разгадать или расшифровать путь природы, это может помочь нам в создании вакцин».
Увеличение функции, показатели смертности: объяснение
В отличие от времен Пастера, современные исследователи, модифицирующие любой вирус, должны следовать очень строгому протоколу. Если они видят какие-либо признаки того, что вирус становится сильнее, а не слабее — что-то, известное как усиление функции, — они должны приостановить свои исследования и уничтожить вирус, чтобы избежать любой возможности попадания более опасной версии в общественное пользование.
Если они видят какие-либо признаки того, что вирус становится сильнее, а не слабее — что-то, известное как усиление функции, — они должны приостановить свои исследования и уничтожить вирус, чтобы избежать любой возможности попадания более опасной версии в общественное пользование.
«По традиции в этой области, если вы создаете химерный вирус, вы должны сравнить его с базовым вирусом. В нашем случае это был вашингтонский изолятор», — говорит Саид. «Подумайте об этом так: из примерно 30 белков один исходит от Omicron, а все остальные — от вашингтонского изолята».
В данном случае химерный вирус был аттенуирован и оставался таким на протяжении всего исследования. Когда исследователи сравнили Omicron, Washington и Omi-S в клетках, выращенных в чашках Петри, говорит Саид, «мы обнаружили, что химерный вирус был слабее по сравнению с вирусом дикого типа».
Но он все же не был таким слабым, как Омикрон, что позволяет предположить, что это был не , а шип, ответственный за относительную непатогенность этого варианта.
«Мы показали, что шип вносит минимальный вклад в болезнетворную способность Омикрона», — говорит Саид.
Они также протестировали три варианта вируса на биоинженерных моделях животных — мышах, созданных таким образом, чтобы они были более восприимчивы к болезням, — и обнаружили те же закономерности.
Исходный вирус убил 100 процентов инфицированных мышей, Omi-S имел 80-процентную смертность, и все мыши пережили контакт с Omicron. Когда эти результаты были первоначально опубликованы исследовательской группой Саида в черновой форме, они вызвали некоторую путаницу, поскольку ряд в основном правых СМИ ошибочно предположили, что эти проценты означают, что вирусы имеют одинаковые показатели смертности или смертности у людей. Это неправда, говорит Саид, и этот момент он и его соавторы прояснили в последних Бумага Nature .
Фактически, мыши, используемые в исследованиях, спроектированы так, чтобы быть высокочувствительными к вирусу, поэтому исследователи могут быстрее и эффективнее изучить его болезнетворный потенциал. В то время как 100 процентов этих мышей умирают, например, при заражении исходным штаммом Вашингтонского вируса, исходы болезни у людей сильно различаются. По оценкам, в результате умерло менее 5 процентов пациентов, заразившихся первоначальным вирусом.
В то время как 100 процентов этих мышей умирают, например, при заражении исходным штаммом Вашингтонского вируса, исходы болезни у людей сильно различаются. По оценкам, в результате умерло менее 5 процентов пациентов, заразившихся первоначальным вирусом.
Версия вируса Omi-S была не только менее смертоносна для мышей, чем тип, который передавался от человека к человеку, когда COVID впервые поразил Америку, она также была настолько смертельна для грызунов, потому что они были биоинженерными, чтобы быть более опасными. склонен к этому.
«Существует огромная разница в проявлении и исходе заболевания между этими искусственно созданными мышами и людьми», — говорит Саид, чья команда выполняла всю свою работу в боксах биобезопасности на объектах NEIDL уровня биобезопасности 3. (Чтобы даже попасть в свою лабораторию, полностью вакцинированные исследователи должны пройти через ряд комнат и взаимосвязанных дверей, надев несколько слоев защитного снаряжения, включая костюм космонавта и капюшон. )
)
Малоизученный белок
Установив, что шиповидный белок был не единственным игроком, снижающим эффективность Омикрона, Саид и исследовательская группа решили выяснить, что еще может быть причиной. В конце концов они остановились на другом белке: неструктурном белке 6, или NSP6.
В дополнение к шиповому белку SARS-CoV-2 состоит из множества других молекул, которые помогают ему выполнять свою грязную работу. По крайней мере четыре, включая шип, являются структурными белками, которые формируют вирусную частицу, когда она выходит из инфицированной клетки. Еще 16 являются неструктурными — они помогают вирусу размножаться, создавая в зараженной клетке среду, необходимую ему для создания собственных копий. Одним из таких неструктурных белков является NSP6. Его работа, по словам Саида, заключается в том, чтобы «способствовать образованию определенных мембранных везикул в инфицированных клетках, которые служат фабриками для амплификации вирусного генома».
Когда они повторили свои эксперименты с использованием химерного вируса, который добавил белок NSP6 Omicron к Omi-S, «мы наблюдали сильное снижение репликации вируса с кинетикой заражения, имитирующей кинетику Omicron в клеточной культуре», согласно статье Nature . Вирус Omi-S плюс NSP6 был слабее. Он также показал снижение бронхиальной инфекции в легких инфицированных мышей по сравнению с Omi-S.
Вирус Omi-S плюс NSP6 был слабее. Он также показал снижение бронхиальной инфекции в легких инфицированных мышей по сравнению с Omi-S.
«В течение нескольких месяцев специалисты занимались изучением влияния всплеска на затухание Омикрона. Это исследование уникально, потому что оно впервые идентифицирует другой белок SARS-CoV-2, NSP6, который способствует ослаблению Omicron в дополнение к спайку», — говорит Флориан Дуам, соавтор исследования и Медицинская школа Чобанана и Аведисяна BU. доцент кафедры микробиологии. «Хотя спайк остается важным для определения затухания Omicron, многое происходит с другими, менее изученными белками SARS-CoV-2, и это исследование впервые указывает на это».
Саид говорит, что белок NSP6 также участвует в воспалении.
«Когда люди заражаются SARS-CoV-2, в легких возникает воспаление, приводящее к пневмонии и острому респираторному дистресс-синдрому», — говорит Саид. «Кажется, NSP6 играет в этом определенную роль. Я думаю, что наше исследование действительно послужит стимулом для изучения NSP6 и выяснения, какие другие функции он выполняет при репликации вируса и последующем заболевании легких — это не один из хорошо изученных белков».![]()
Поймите SARS-CoV-2, затем сделайте его менее опасным
Исследовательская группа вскоре приступит к дальнейшему изучению NSP6, но говорят, что последние результаты впечатляют, потому что они открывают новый путь для борьбы с COVID. По словам Дуама, понимание небольших генетических различий между вариантами имеет решающее значение для получения нового понимания того, как вирус вызывает заболевание.
«Поменяв местами генетические характеристики между двумя вариантами с разной вирулентностью, исследователи могут определить ключевые компоненты, участвующие в болезнетворном потенциале SARS-CoV-2», — говорит он. «Это исследование имеет решающее значение не только потому, что оно говорит нам, какие элементы вируса регулируют его вирулентность, но также подчеркивает потенциал этих вирусных элементов в качестве мишеней для лекарств, что в конечном итоге расширяет набор инструментов для преодоления пандемии. ».
Саид, который недавно был соавтором исследования под руководством Института рака Дана-Фарбер, в ходе которого было обнаружено новое лекарство-приманка для рецепторов, нейтрализующее SARS-CoV-2, говорит, что исследования, подобные его, могут помочь ученым «приспособить свои усилия по разработке противовирусных препаратов к особый белок».
Ценность результатов отражена в решении Nature опубликовать работу группы. Согласно престижному научному журналу, базирующемуся в Соединенном Королевстве, его критерии публикации требуют, чтобы исследование было оригинальным, представляло междисциплинарный интерес и имело «выдающуюся научную значимость». Nature сообщает, что получает 200 статей каждую неделю — и принимает только 8 процентов из них, используя процесс, который «независим, не зависит от научных или национальных предубеждений отдельных лиц». Даже после этого статьи доходят до стадии публикации только после тщательного рецензирования, когда внешние эксперты тратят месяцы на оценку оригинальности исследования и его тщательную проверку на наличие технических проблем.
Инструменты в борьбе с пандемией
Те, кто не входил в научное сообщество и следил за ходом этого конкретного исследования, могут задаться вопросом, почему окончательная версия — с другим резюме или аннотацией и дополнительными данными — не является прямой копией, с точками «I» и перечеркнутыми буквами «T». , ранней черновой версии, которая привлекла внимание всего мира.
, ранней черновой версии, которая привлекла внимание всего мира.
Основная причина: академическая открытость о научном путешествии. В рамках процесса публикации Nature исследовательская группа разместила предварительный обзор своих результатов в bioRxiv, онлайн-архиве черновиков — официально называемых препринтами — статей по биологии. Он используется исследователями, чтобы быть прозрачными в своей работе, делиться первоначальными выводами и получать предложения по улучшению своих окончательных работ перед рецензированием. Это немного похоже на то, когда архитектор показывает вам свой первый план пристройки или новой кухни; это дает вам представление о проекте, но не все окончательные детали и уточнения. Обычная часть научного процесса в современную эпоху, публикация препринтов отлично подходит для продвижения открытого доступа, но может обычно означать — так же, как путешествие от кухонного эскиза до готового дизайна — опубликованные статьи продвинулись вперед по сравнению с их ранними набросками.
Эта препринтная статья была написана еще в марте 2022 года и содержала только одну часть общих выводов — исследование спайкового белка, проведенное командой. Жизненно важная работа над NSP6, которая частично проводилась при поддержке коллег-ученых, была завершена после того, как была написана эта первоначальная статья; он был добавлен к исходному материалу, который остался в окончательной версии, спустя несколько месяцев.
«В смысле эволюции, особенно в сверхбыстром темпе репликации вируса, каждая геномная мутация что-то значит и может быть подсказкой для выявления еще одного важного феномена в развитии инфекций и болезней», — говорит Да-Юань Чен, исследователь с докторской степенью. в лаборатории Саида и ведущий автор Бумага Nature . «Понемногу, чем больше мы понимаем вирус, тем более правильную информацию мы будем получать. Тогда появится больше точек входа, лекарств и стратегий, которые мы можем рассматривать как инструменты для лечения болезней и борьбы с пандемией».
